# Unidade 2: As transformações dos materiais
Tema 01: A constituição da matéria.
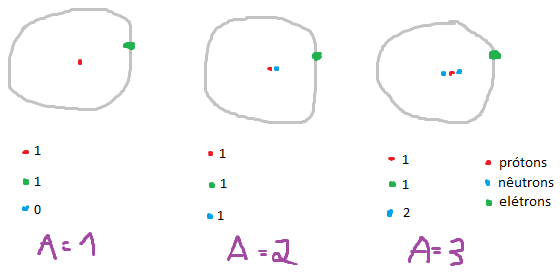
Caracterizar, localizar e calcular as sub partículas atômicas (prótons,
elétrons e nêutrons). Prótons: são as sub partículas de carga positiva,
e se localizam no núcleo do átomo. Elétrons:
são as sub partículas de carga negativa, e se localizam na eletrosfera. Nêutrons: são as sub partículas de carga
neutra, e se localizam no núcleo do átomo, para não deixar prótons e nêutrons
se atraírem.
Caracterizar átomo neutro e íons (cátions e ânions). Neutro: quando o número de prótons for igual ao
número de elétrons. Íon: quando ganha ou perde elétrons. O numero de prótons é
diferente do número de elétrons: a) cátion: quando perde elétrons e fica com
carga positiva; b) ânion: quando recebe elétrons e fica com carga negativa.
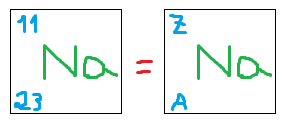
Conceituar e calcular número atômico e massa. Número Atômico (Z): é a quantidade de prótons que um átomo possui, ou seja, mesmo elemento
químico, mesmo número atômico. Massa
(A): toda a massa se encontra no núcleo:
(massa = prótons + nêutrons).
Conceituar elemento químico e conhecer suas representações. Elemento Químico: conjunto de átomos que possuem o mesmo número de prótons, mesmo número
atômico. Representações: 1ª letra minúscula; 1ª maiúscula + 2ª minúscula; nome
em latim (língua morta).
Outras maneiras:
(assim na forma escrita, porque na tabela o numero atômico é em cima e a
massa é embaixo).
Conceituar, aplicar e diferenciar elementos isótopos. Isótopos: são dois ou mais átomos do mesmo elemento que possuem no atômico
igual, mas massas diferentes. O número de prótons define o elemento (se todos
os átomos têm o mesmo numero de prótons, são do mesmo elemento):
Extrair dados a respeito dos elementos químicos por meio da utilização
da tabela periódica e relacionar ao número de elétrons, nêutrons, prótons,
massa e as propriedades químicas. Representação:
Reconhecer e conhecer as famílias e os períodos. Famílias: linha vertical; propriedades semelhantes; quantidade de elétrons na última camada (fam. 1=1e, 2=2e, 13=3e, 14=4e, 15-5e, 16=6e, 17=7e, 18=18e). Famílias nomes: 1-Metal Alcalino
2-Metal Alcalino Terroso
3 a 12-Elemento de Transição
13-Familia do Boro
14-Familia do Carbono
15-Familia do nitrogênio
16-Calcogênio
17- Halogênio
18-Gases Nobres
Períodos: linha horizontal; são 7; no atômico
crescente; o no indica a quant. de órbitas.
Reconhecer o número atômico como critério básico da classificação
periódica moderna. A tabela periódica atual é do Mosely, e os
elementos são organizados na ordem crescente do número atômico (ex.: H: Z=1; He:
Z=2; Li: Z=3 etc.).
Identificar os símbolos de elementos mais comuns na tabela periódica. H=hidrogênio, He=hélio, C=carbono,
N=nitrogênio, O=oxigênio, F=flúor, Na=sódio, S=enxofre, Cl=cloro, Ar=argônio,
K=potássio, Ca=cálcio, Fe=ferro, Br=bromo, Ba=bário, Au=ouro, U=urânio e
P=fósforo.
Classificar e caracterizar os elementos em: Metal, Ametal e Gases
nobres. Ametal: B, C, N, O, F, Si, P, S, Cl, As, Se,
Br, Te, I e At. Gases Nobres: He,
Ne, Ar, Kr, Xe, Rn, Uuo. Metal:
todos os que não são nem ametais nem gases nobres.
Tema 02: Milhões de Substâncias.
Classificar as substâncias em iônicas, metálicas, covalentes ou
moleculares, a partir de propriedades como: temperaturas de fusão e ebulição,
estado físico nas condições ambientes e condutibilidade elétrica. Regra do Octeto: estabilidade acontece com 8 elétrons na [ultima órbita (exceto: H, He,
Li, Be e B – estáveis com 2 na última órbita). Valência: no de elétrons que o átomo pode ganhar ou
perder. Família: 1:+1, 2:+2, 13:+3, 14: +4/-4, 15:-3, 16:-2, 17:-1.
Reconhecer que as ligações químicas se estabelecem pela união entre
átomos por meio da interação dos elétrons da camada de valência e
representá-las através dos modelos de Lewis (fórmula eletrônica), estrutural e
molecular.
Explicar as ligações iônicas e covalentes pela regra do octeto,
reconhecendo suas limitações. Ligação Iônica: Metal: facilidade para perder elétrons
> cátion. Ametal: facilidade para ganhar elétrons > ânion. Essa ligação
acontece em metal e ametal; elétrons doados=elétrons recebidos; íons de cargas
opostas se atraem.
Formula Iônica: Na+1Cl-1. Fórmula Mínima:
NaCl.
Ligação Covalente: acontece entre metal e ametal; os
átomos se unem por compartilhamento de elétrons, formando moléculas.
Fórmuas: 1) molecular: Cl2. 2) eletrônica: Clo---oCl. 3) estrutural: Cl---Cl.
Prever o tipo de ligação formada a partir da distribuição eletrônica dos
átomos ligantes e de suas posições na tabela.
# Radiação:
Caracterizar e diferenciar as radiações do tipo alfa, beta e gama. Alfa: 2P + 2N (perde); instabilidade no núcleo;
altera o elemento e a massa. Beta: libera
elétrons; instabilidade no núcleo; muitos nêutrons (que se dividem em prótons e
elétrons); altera o elemento, mas não a massa. Gama: libera energia na forma de ondas eletromagnéticas;
instabilidade no núcleo; mesmo elemento.
Aplicar em situação problema os conceitos estudados em sala de aula.
# Laboratório




Nenhum comentário:
Postar um comentário